| La charge électrique globale de
n’importe quel de ces atomes est nulle puisqu’ils
contiennent
chacun un même nombre de ces divers
éléments. Cependant, certaines
molécules chimiques (acides, bases et sels) contiennent des
atomes ayant "emprunté" un électron à
d'autres avec lesquels ils se sont combinés. A la
dimension moléculaire, l' eau,
« apprivoise » les forces électriques et
lorsque ces composant électriquement chargées ("ions")
y sont dissous, ils perdent un électron ou en
"empruntent" un autre, en étant parfois temporairement séparés.
Ce genre de solution (l'eau de mer, par exemple) peut donc conduire
l'électricité, et on peut parfois
séparer ses ions par un courant électrique (pour
plus de détails : référence
#2.) En faisant fondre certains composés
ioniques en les chauffant (par exemple du sel fondu) on peut aussi
en séparer les composés qui y sont dissous,
à l’aide d'un courant électrique.
Par ailleurs, des ions se forment dans les gaz
raréfiés si une tension suffisante y est
appliquée (et par d'autres procédés).
Ils transmettent alors des courants électriques dans les
appareils
à éclairage fluorescent (aidé par des
électrons libres), et aussi dans l'ionosphère et
dans l'espace plus lointain.
- Dans le vide, on peut
également "évaporer
(faire bouillir)" les électrons d’un objet chaud ( référence
#3).
Par d’autres méthodes, dans le vide, on peut
créer des ions "libres" positifs ou négatifs
(atomes ayant perdu un ou plusieurs électrons, ou auxquels
se sont joints des électrons « immigrés
»). Certains peuvent être
accélérés en laboratoire par des
"accélérateurs" à des vitesses proches
de celle de la lumière, et acquérir de hautes
énergies. Une grande partie de nos connaissances sur les
atomes proviennent des études des collisions de ces
particules
rapides avec des atomes.
-
L'élément le plus léger est
l’atome d' hydrogène, dont la
partie positive est un unique "proton",
1836 fois plus lourd que l'électron. Le "poids
atomique" des autres atomes correspond au nombre approximatif
de fois qu’ils sont plus lourds que l'hydrogène,
par exemple 4 pour la partie principale de l'hélium, 12 pour
celle du carbone, 14 pour l'azote, 16 pour l'oxygène et
ainsi de suite, jusqu'à 238 pour la principale
variété de l'uranium, l'atome le plus lourd
présent dans la nature.
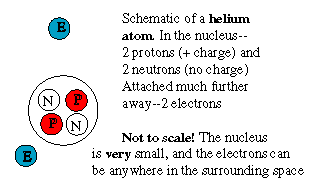
Le noyau d'hélium a une charge positive de
2 protons, mais est 4 fois plus lourd. De même, le carbone
pèse 6 fois sa charge. Cela veut dire que ces noyaux
contiennent de plus un nombre égal de " protons sans
charge",
appelés neutrons. Un neutron libre
(découvert par Chadwick en 1931) est
éjecté au cours de certaines collisions
nucléaires (voir ci-dessous), mais reste instable
--et en moyenne après 10 minutes, il se transforme en un
proton, un électron et un très léger
neutrino, sans charge.
1 gramme d'hydrogène, 4 grammes d'hélium, 12 de
carbone etc. contiennent A = 6.022 1023 atomes,
une
constante connue comme le nombre d'Avogadro
. C'est aussi le nombre de molécules de
2 grammes d'hydrogène (molécule H2),
18 grammes d'eau (molécule H2O), 44
grammes de dioxyde de carbone (molécule CO2)
et ainsi de suite - -le nombre formé par la somme des masses
atomiques des composants et qui donne le poids
moléculaire
.
- Pour désigner un
élément dans la nature, un symbole
abrégé est utilisé. Exemples :
H pour l'hydrogène, O pour l'oxygène, C pour le
carbone, U pour l'uranium, Na pour le sodium (natrium), Pb pour le
plomb (plumbum), Cl pour le chlore, pour Fe pour le fer (Ferrum), etc.
En fait, la plupart des atomes naturels ont plusieurs
variétés (isotopes), qui
diffèrent très peu, d’un poids
très proche de la
masse de leur proton. Pour désigner un isotope, on ajoute
à son symbole un exposant
désignant son poids atomique. Par exemple, le chlore naturel
est un mélange d'environ 75% de 35Cl
et de 25% de 37Cl.
On connaît 3 isotopes pour
l’Hydrogène (H) : l'hydrogène ordinaire
1H
, l’hydrogène "lourd" 2H
(dénommé aussi "deuterium"
D) composant 1 / 6000 de l'atome dans la nature, et le "tritium" 3H
qui est instable, mais peut être
artificiellement créé, et se détruit
en moyenne en 12,5 ans (sa "demi-vie",
délai au bout duquel seule la moitié de ses
atomes a disparue). Il se transforme en un isotope d'hélium 3en
émettant un électron et un de ses neutrons (voir
(7) ci-dessous) se transforme en proton.
- 6. Mis à part les
électrons, la masse de l'atome est concentrée
dans un très compact "noyau atomique".
- Le noyau de
l'isotope le
plus courant de l'hélium vaut le double de la charge
positive des protons, mais près de 4 fois leur masse. En
fait, il contient deux protons et deux neutrons,
des particules semblables aux protons, mais
légérement plus lourdes et sans charge
électrique. Les légers atomes
possèdent un nombre égal de protons et de
neutrons, par exemple, 6 +6 pour 12C,
8+8 pour 16O. Pour les atomes plus lourds, la
proportion de
neutrons devient majoritaire, d’autant plus que le
poids
atomique augmente. Par exemple238U
possède 92 protons et 146 neutrons. Les isotopes d'un
même élément ont le même
nombre de protons ( égal au nombre
d'électrons et déterminant les
propriétés chimiques), mais un nombre
différent de neutrons. Ce déséquilibre
(voir plus loin) joue un rôle crucial dans la
libération de l'énergie nucléaire par
la réaction de fission en chaîne.
- Les noyaux atomiques peuvent
être instables ---en particulier, pour
les éléments très lourds
et pour les isotopes dont le nombre de neutrons diffère
sensiblement de celui de l’isotope le plus commun. Les noyaux
instables peuvent aboutir par "transformation radioactive"
à un état plus stable. La plupart des noyaux
radioactifs le font en émettant l'un des trois types de "radiations
nucléaires", désignées, pour
des raisons historiques, par les 3 premières lettres de
l'alphabet grec, soit les radiations alpha, beta, gamma
.
Les particules Alpha (α) sont des
noyaux d'hélium, dont l’émission
transforme un atome en un autre diminué de 2 protons et 2
neutrons (la particule alpha, après avoir
été ralentie par les collisions, se combine
à deux électrons du milieu environnant et devient
un hélium normal, tandis que l'atome émetteur
récupère deux électrons, ce qui
conserve neutre le matériau environnant. Les particules
alpha pénètrent très peu dans la
matière et ne peuvent traverser la peau. Toutefois, ils sont
très nocifs en cas d'ingestion - comme dans le cas
d'Alexandre Litvinenko, un officier russe exilé à
Londres, qui
y est décédé en Novembre 2006
après avoir été empoisonné
au polonium α-émetteur.
Les particules Beta sont des
électrons rapides, émis lors de la transformation
d’un neutron en proton. Il s'agit
généralement des neutrons d’un noyau
instable, encore que des neutrons libres, produits en laboratoire au
cours de collisions à haute énergie (
à partir de particules
accélérées, ou par des particules
alpha naturelles frappant des noyaux de béryllium) peuvent
aussi faire l'objet de ce type de transformation, avec une demi-vie
d'environ 10 minutes, production d’un proton,
d’un électron et d'un "neutrino"
", sans charge, presque pas de masse ou de ses deux "anti-neutrino,
tous pouvant traverser la matière pratiquement sans
entraves.
Les rayons Gamma , analogues aux rayons X, sont
des variétés du rayonnement
électromagnétique [voir ci-dessous] en liaison
avec la lumière et les ondes radio. Comme pour la
lumière visible, ils ne peuvent être
émis
qu’à des niveaux d’énergie
bien définis, par des électrons situés
à un niveau d’énergie "excités"
et sautant d'un "niveau d'énergie"
à un autre, plus bas. Les rayons gamma se
créent à partir des noyaux en passant d'un niveau
d'énergie excité à un autre - voire le
plus bas, le stable "niveau fondamental."
- Le terme radiation
doit être utilisé avec précaution. Les
physiciens l’appliquent habituellement au "rayonnement
électromagnétique (EM) ", une famille
de perturbations se propageant à travers l'espace et qui
regroupe les ondes radio, micro-ondes, la lumière (visible,
infrarouge et ultraviolet), rayons X, rayons gamma. Ces
variétés recouvrent l’ensemble des
radiations. Elles ont des longueurs d'onde différentes et
sont décrites qualitativement dans la référence
#4.
Les rayonnements
Nucléaires ,
émis par les noyaux instables, peuvent être
électromagnétiques (rayons gamma) ou
constitués de particules possédant une masse
(rayons alpha et bêta) et quelquefois accompagnées
de rayons gamma. De plus, les isotopes artificiels peuvent
émettre des neutrons et des positons (électrons
positifs).
Trop de personnes ignorent la différence entre
«radiations nucléaires» et
«rayonnement
électromagnétique»! On
réchauffe
fréquemment des aliments au four à micro-ondes
mais les noyaux atomiques ne sont alors pas en jeu mais
seulement des
ondes radio très courtes, dont l'énergie est
absorbée en majeure partie par la cuisson de la nourriture
(et non par des atomes individuels). Ce débat sur
l'énergie nucléaire s’applique
à la plupart des radiations nucléaires. Dans cet
exemple (ici seulement ) le mot
«radiation» ne veut pas dire radiation
nucléaire.
- Dans un atome, les
électrons, négatifs, entourent le noyau, positif,
qui les retient par attraction électrique, comme les
planètes sont retenues par la gravité du Soleil.
Il y a cependant de grandes différences car les lois de
Newton sont modifiées à
l’échelle des distances atomiques et subatomiques,
qui est du domaine de la mécanique quantique.
En un sens, la matière se comporte comme le sable :
à grande échelle, il
s’écoule comme un fluide, mais à petite
échelle, son comportement dépend de l'existence
des grains individuels. La « granularité
» "obéit aux phénomènes
quantiques et est déterminée par "h",
la constante naturelle dite "Constante
de Planck" d’après son
découvreur. Pour plus d'informations sur les
phénomènes quantiques, voir référence
#5 et les 7 fichiers web qui lui sont
liés (Q2 ... Q8.htm).
h
et la lumière (ou n’importe
quel rayonnements EM) sont liés par une
équation fondamentale. On dit souvent que la
lumière peut à la fois
être onde et particule. Fondamentalement, le rayonnement EM
se propage comme une onde avec une longueur d'onde
L (également désignée par
λ, lambda, la lettre grecque L),une vitesse c ( la vitesse
de
la lumière, 300.000 km / sec). Un "train d'ondes" entier, de
vitesse c, passe chaque seconde par un point
(vide) de l’espace, découpé en
oscillations de haut en bas (ici, peu importe qu’elles soient
dues à la force magnétique ou
électrique), séparées chacune
d’une longueur L, de sorte que le nombre total
d’excursions de haut en bas ( la fréquence
f de l'onde) est par seconde
f = c/L
(aussi désignée par ν, la lettre grecque
N). La longueur d'onde peut être mesurée, et
caractérise tous les phénomènes
optiques.
Toutefois,
quand une onde EM perd
de son énergie, cela ne concerne que
l'énergie des "photons", dont chacun contient une
énergie :
E = h f
avec h la constante de Planck.
En Allemagne, Max Planck (prix Nobel 1918) a proposé cette
équation en 1900 à propos de la
répartition des couleurs émises par les objets
chauds, mais son importance n’a été
reconnue pour les processus atomiques qu’après
qu’Einstein eu interprété en 1905
l'éjection des électrons atomiques soumis
à des lumières de différentes couleurs
(effet photo électrique). C'est pour
cela d’ailleurs qu’Einstein a reçu son
prix Nobel en 1921 et
non pas pour sa découverte de la
relativité! Les
photons sont analogues à des particules, juste
localisées à l'atome qui absorbe
l'énergie, et ne se répartissant pas dans tout
l'espace comme pour les ondes. Pour plus de détails, voir la
référence
#4
et les pages web
référence
#5 ci-dessus.
Selon les règles quantiques, un électron
appartenant à un atome de gaz ne peut se déplacer
que sur certaines orbites bien définies et sur aucune autre
- comme l' onde des modèles
stables bien définis, par
exemple le son d'un instrument de musique. Quand un atome est
"excité" (par exemple, par les forces électriques
des tubes fluorescents ou des lampes à vapeur de sodium de
l'éclairage publique), un électron peut
être déplacé à un niveau
plus énergique, puis, revenant à un niveau
inférieur, émettre de la lumière dans
des fréquences bien définies (exemples
à
référence
#6 ), donc perçue (si visible), avec des
couleurs spécifiques. Chaque fréquence
représente (par l'équation ci-dessus), la
différence d'énergie entre deux états
de l'atome. Tous ces électrons abotissent au "niveau
fondamental ", celui de l'énergie la
plus basse, qui est stable. Ce niveau (déterminé
par les lois quantiques), empêche l'électron de se
déplacer plus loin et de "tomber" dans le noyau de l'atome.
Pour le plaisir : Du
fait de la radioactivité
d’éléments comme l'uranium et le
potassium, l'énergie nucléaire
réchauffe aussi
l’intérieur de la Terre, surtout la
croûte terrestre. Bien que les éléments
radioactifs ne constituent qu'une infime partie des composants de la
Terre, la chaleur qui résulte de l’absorption de
leurs rayonnements ne peut facilement s’échapper.
Considérez que vous occupez un espace d’un
mètre carré : si la croûte terrestre
présente partout les mêmes
caractéristiques chimiques, toute la chaleur radioactive
produite à l’aplomb d’une colonne de 100
km au-dessous de vous ne peut sortir que par cette petite
région. (La profondeur pourrait être plus grande,
mais la production de chaleur est faible aux grandes profondeurs). On
peut dire aussi que toute la chaleur des centrales
géothermiques, des sources chaudes et des volcans provient
de noyaux atomiques
Et soit dit en
passant ...L’hélium
de la Terre (celui des ballons de jeu,
par exemple) est en pratique totalement extrait du gaz naturel, et
trouve son origine dans les α-particules
émises par
l'uranium, le thorium ou certains produits affiliés. Pour
preuve, l'hélium du Soleil contient une petite
quantité d’isotope 3He (1
neutron, deux protons), mais l'hélium terrestre 4He
est presque pur.
Problèmes:
(réponses en section S-8A-5)
- 1. Si le chlore est
composé de 25% de 37Cl et 75 % de 35Cl,
et A est le nombre d'Avogadro - quelle est la masse de A
atomes de
chlore? (C’est le poids atomique effectif du chlore naturel).
- 2. A l’ aide
d’un dictionnaire, définir brièvement
par ordre alphabétique, avec vos propres termes :
Radiation, particule alpha, atome, poids atomique, nombre d'Avogadro,
particules électromagnétiques à
rayonnement bêta, électron, niveau
d'énergie, états de l'atome, états
excités du noyau atomique, fréquence des ondes
EM, rayons gamma, niveau de base , demi-vie, ion, isotope,
molécule, poids moléculaire, neutrino, neutron,
radiation nucléaire, noyau (de l'atome), photon, constante
de Planck, proton, mécanique quantique.
- Les ions à
très haute énergie en provenance de l'espace
(«rayons cosmiques") parviennent au sommet de la
magnétosphère terrestre, heurtent des atomes et
s’éparpillent en fragments, dont certains sont des
neutrons. Un neutron, qui n’est pas
dévié
par les forces magnétiques, peut
s’échapper sur une trajectoire rectiligne, alors
que les électrons et les protons sont
déviés et peuvent être
piégés magnétiquement. Ces «
éclaboussures » dans
l'atmosphère
obéissent généralement à la
force magnétique et retournent à celle-ci.
Ces fragments pourraient-ils être à l'origine de
la "ceinture des radiation", piégée par le champ
magnétique de la Terre?
- La demi-vie
d’un isotope radioactif étant de 2 jours, combien
faut-il environ de temps pour qu’il n’en reste
qu’1 / 1000 dans un échantillon donné?
- 5. Le poids de
l'hydrogène (composé de molécules H2
) est d’environ 90 grammes par mètre cube. Combien
de molécules d'hydrogène y a- t’il dans
un micron cube (un micron est le millionième du
mètre)?
|
