|
Gli atomi completi, con ugual numero di elettroni e protoni, hanno carica elettrica nulla. Alcune molecole chimiche tuttavia (acidi, basi e sali) sono formate da atomi che "prendono in prestito" un elettrone da altri atomi con cui sono combinati. Poiché l'acqua, su scala molecolare, indebolisce le forze elettriche, quando tali composti sono sciolti in acqua, i componenti elettricamente carichi ("ioni"), mancanti di un elettrone o avendone uno in più, "preso in prestito", possono temporaneamente separarsi. Tali soluzioni (per esempio l'acqua di mare) quindi conducono l'elettricità e i loro ioni possono talvolta venire separati per mezzo di una corrente elettrica (per maggiori dettagli, ved. il riferimento n.2). Anche i composti ionici liquefatti con il calore (per esempio sali fusi) e i composti disciolti in essi possono essere separati con una corrente elettrica.
Inoltre, gli ioni si formano in gas rarefatti quando viene applicata una sufficiente tensione elettrica (o anche con altri metodi). Essi conducono la corrente elettrica nei tubi fluorescenti (con l'aiuto di elettroni liberi) e inoltre nella ionosfera e nello spazio molto lontano.
-
Gli elettroni possono anche "evaporare" da un oggetto caldo nel vuoto (
riferimento n.3). Altri metodi permettono di produrre, nel vuoto, ioni "liberi" positivi o negativi (cioè atomi che hanno perduto uno o più elettroni, oppure atomi che hanno catturato degli elettroni in più). Questi ioni possono essere accelerati in laboratorio da opportuni "acceleratori" fino a velocità prossime a quella della luce, fornendo loro alte energie. La maggior parte della nostra conoscenza sugli atomi proviene dagli studi delle collisioni di queste veloci particelle con gli atomi.
-
L'elemento con l'atomo più leggero è l'idrogeno, e la sua parte positiva è nota come "protone", 1836 volte più pesante dell'elettrone. Il "peso atomico" degli altri atomi fornisce approssimativamente il numero di volte di cui questi atomi sono più pesanti di quello dell'idrogeno, per esempio 4 per il componente principale dell'elio, 12 per quello del carbonio, 14 per l'azoto, 16 per l'ossigeno e così via, fino a 238 per la varietà principale dell'uranio, l'elemento più pesante che esista in natura.
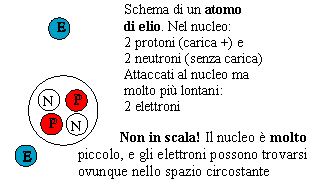
Il nucleo di elio ha la carica positiva di 2 protoni, benché sia 4 volte più pesante. Similmente il carbonio ha una carica soltanto 6 volte quella dell'idrogeno. Questo indica che questi nuclei contengono un ugual numero di "protoni senza carica", chiamati "neutroni". Il neutrone libero (scoperto da Chadwick nel 1931) viene emesso da certe collisioni nucleari (ved. più avanti), ma è instabile - dopo un tempo medio di circa 10 minuti si trasforma in un protone, un elettrone e un leggerissimo neutrino, privo di carica.
1 grammo di idrogeno, 4 grammi di elio, 12 di carbonio, ecc., tutti contengono A = 6,022 1023 atomi, una costante nota come numero di Avogadro. Questo è anche il numero di molecole in 2 grammi di idrogeno (la molecola è H2), in 18 grammi di acqua (molecola H2O), in 44 grammi di anidride carbonica (molecola CO2) e così via - i valori ottenuti sommando i pesi atomici dei componenti danno il peso molecolare.
- Per indicare un elemento in natura si usa un simbolo, per esempio H per l'idrogeno, O per l'ossigeno, C per il carbonio, U per l'uranio, Na per il sodio (Natrium, in latino), Pb per il piombo, Cl per il cloro, Fe per il ferro, ecc. In realtà, molti atomi in natura esistono in diverse varietà (isotopi), che differiscono tra loro in peso di quantità molto prossime al peso di un protone. Per indicare uno specifico isotopo, si aggiunge al simbolo un apice che dà il peso atomico. Per esempio, in natura il cloro è una miscela formata approssimativamente dal 75% di 35Cl e dal 25% di 37Cl.
L'idrogeno (H) ha 3 isotopi noti: l'idrogeno ordinario 1H, l'idrogeno "pesante" 2H (noto anche come "deuterio" D), presente in natura nella percentuale di un atomo ogni 6000 atomi di idrogeno ordinario, e il "trizio" 3H che è instabile, deve essere prodotto artificialmente e decade con una vita media di 12,5 anni (il "tempo di dimezzamento" è il tempo dopo il quale sono rimasti soltanto la metà di atomi). Esso si trasforma in un isotopo dell'elio 3He emettendo un elettrone mentre uno dei suoi neutroni (ved. il punto 7 più avanti) diventa un protone.
- A parte gli elettroni, la massa di un atomo è concentrata in un "nucleo atomico" molto compatto.
- Il nucleo del più comune isotopo dell'elio ha il doppio della carica positiva del protone, ma circa 4 volte la sua massa. Risulta quindi che contiene, oltre a due protoni, anche due neutroni, particelle simili ai protoni ma leggermente più pesanti e senza carica elettrica. Gli atomi leggeri hanno circa lo stesso numero di protoni e di neutroni, per esempio 6+6 nel 12C, 8+8 nel 16O. Negli atomi più pesanti i neutroni sono in maggioranza, e la loro percentuale aumenta ancora all'aumentare del peso atomico - per esempio, l'uranio 238U ha 92 protoni e ben 146 neutroni. Gli isotopi dello stesso elemento hanno lo stesso numero di protoni (che uguaglia il numero di elettroni e determina le proprietà chimiche), ma un diverso numero di neutroni. Questo squilibrio (che verrà discusso più avanti) gioca un ruolo cruciale nella liberazione di energia nucleare durante la reazione a catena della fissione.
- I nuclei atomici possono essere instabili - in particolare, negli elementi molto pesanti e negli isotopi in cui il numero di neutroni differisce in modo significativo dal numero presente negli isotopi prevalenti in natura. Questi nuclei instabili possono subire un "decadimento radioattivo" verso stati più stabili.
La maggior parte dei nuclei radioattivi subiscono questo decadimento emettendo uno dei tre tipi di "radiazioni nucleari", indicate per ragioni storiche con le prime 3 lettere dell'alfabeto greco: raggi α, β, γ o alfa, beta, gamma.
Le particelle alfa (α) sono nuclei di elio, ed emettendo una tale particella un atomo si trasforma in un altro con 2 protoni in meno e 2 neutroni in meno (la particella alfa, dopo essere stata rallentata da varie collisioni, si combina con due elettroni nelle vicinanze e diventa un normale atomo di elio, mentre l'atomo che l'ha emessa perde due elettroni, rendendo neutro elettricamente il materiale circostante). Le particelle alfa hanno un raggio d'azione molto limitato nella materia e difficilmente penetrano nella pelle. Tuttavia possono causare un gran danno se ingerite, come nel caso di Alexander Litvinenko, un funzionario russo che aveva ottenuto asilo politico a Londra, che morì nel Novembre 2006 dopo essere stato avvelenato con polonio che emetteva particelle α.
Le particelle beta sono elettroni veloci, emessi quando un neutrone si trasforma in un protone. Questo in genere capita ai neutroni all'interno di nuclei instabili. Tuttavia, i neutroni liberi, prodotti nelle collisioni ad alta energia nei laboratori (da particelle accelerate o anche da particelle alfa naturali che colpiscono nuclei di berillio) subiscono anch'essi una tale conversione, con una vita media di circa 10 minuti, producendo un protone, un elettrone e un "neutrino", senza carica e quasi senza massa, oppure il suo gemello "anti-neutrino", entrambi con la proprietà di attraversare la materia quasi indisturbati.
I raggi gamma sono simili ai raggi X, un tipo di radiazione elettromagnetica (ved. il prossimo punto più avanti) del genere della luce e delle onde radio. Come la luce visibile può essere emessa ad energie ben definite da elettroni atomici in atomi "eccitati", mentre saltano da un "livello energetico" a uno più basso, così i raggi gamma sono prodotti da nuclei che passano da un livello energetico a un altro - in genere al livello più basso, lo "stato fondamentale", che è stabile.
- La parola radiazione deve essere usata con cautela. I fisici in genere l'applicano alla "radiazione elettromagnetica (EM)", una famiglia di perturbazioni che si propagano attraverso lo spazio e che includono le onde radio, le microonde, la luce (visibile, infrarossa e ultravioletta), i raggi X, i raggi gamma e tutti gli intervalli tra queste. Esse differiscono per la lunghezza d'onda e sono descritte qualitativamente nel riferimento n.4.
La radiazione nucleare emessa dai nuclei instabili può essere elettromagnetica (raggi gamma) oppure può consistere di particelle con una massa (raggi alfa e beta), magari accompagnate anche da raggi gamma. Gli isotopi artificiali possono inoltre emettere anche neutroni e positroni (elettroni positivi).
Troppe persone non si rendono conto della differenza tra "radiazione nucleare" e "radiazione elettromagnetica"! Nel linguaggio colloquiale, noi "irradiamo" il cibo nel forno a microonde, e in tal caso non c'entrano i nuclei atomici, ma soltanto onde radio di cortissima lunghezza d'onda, la cui energia è assorbita dalla massa di cibo (non dai singoli atomi) e la riscalda. Questa discussione sull'energia nucleare riguarda principalmente la radiazione nucleare, per cui in queste pagine (ma soltanto qui!) la generica parola "radiazione" implica la radiazione nucleare.
- In un atomo gli elettroni negativi circondano il nucleo positivo e sono tenuti insieme dall'attrazione elettrica, similmente al modo con cui i pianeti sono tenuti insieme dalla gravità del Sole.
Esiste però una grande differenza, poiché le leggi di Newton si modificano alla scala delle distanze atomiche e subatomiche, per seguire la meccanica quantistica. In un certo qual modo la materia si comporta come la sabbia: su grande scala essa scorre come un fluido, ma su piccola scala il comportamento dipende dall'esistenza dei singoli granelli. La "granulosità" che regola i fenomeni quantistici è determinata da "h", una costante della natura chiamata "costante di Planck" dal nome del suo scopritore. Per maggiori notizie sui fenomeni quantistici, si può vedere il riferimento n.5 e le altre 7 pagine web collegate (Iq2 ... Iq8.htm).
Un'equazione fondamentale che contiene h riguarda la luce (oppure ogni altra radiazione elettromagnetica). Un'affermazione udita spesso è che la luce può essere contemporaneamente un'onda e una particella. Sostanzialmente, quando una radiazione EM si propaga, si comporta come un'onda di lunghezza d'onda L (indicata anche con la lettera greca λ, lambda), che viaggia a una velocità c (la velocità della luce, 300·000 Km/sec). Quando l'onda passa per un punto nello spazio (vuoto), un intero "treno d'onda" di lunghezza c lo attraversa ogni secondo, suddiviso in tante oscillazioni su e giù (della forza elettrica o magnetica, ma questo non ha importanza qui), ciacuna di lunghezza L, per cui il numero totale di oscillazioni su e giù ogni secondo, cioè la frequenza f dell'onda, è
f = c/L
(indicata anche con la lettera greca ν). La lunghezza d'onda può essere misurata, e l'onda descrive tutti i fenomeni ottici.
Tuttavia, quando un'onda EM cede la sua energia, si è scoperto che ciò avviene soltanto in quantità "discrete" di energia, i "fotoni", ciascuno dei quali contiene l'energia
E = h f
dove h è la costante di Planck.
Max Planck (premio Nobel nel 1918) propose questa equazione nel 1900 in Germania per spiegare la distribuzione di colore emessa dagli oggetti caldi, ma il suo significato nei processi atomici fu compreso solo dopo la spiegazione dell'effetto fotoelettrico data da Einstein nel 1905. Si trattava di interpretare correttamente l'emissione di elettroni da parte di atomi colpiti da luce di diversi colori. Fu questo che fruttò nel 1921 ad Einstein il premio Nobel, non la sua teoria della relatività del 1905! I fotoni si comportano un po' come particelle, localizzate proprio nell'atomo che assorbe l'energia, e non distribuiti su tutto lo spazio come un'onda. Per maggiori dettagli, ved. il
riferimento n.4 e le pagine collegate al riferimento n.5 citato sopra.
A causa delle regole quantistiche, un elettrone in un singolo atomo di gas può muoversi soltanto in una certa ben definita orbita e non in un'altra, come un'onda con una ben definita configurazione stabile, per esempio una nota in uno strumento musicale. Quando un atomo è "eccitato" (per esempio da forze elettriche in un tubo fluorescente oppure in una lampada al sodio nelle illuminazioni stradali), un elettrone può essere sollevato a un livello energetico più alto; allora, quando poi ritorna al livello più basso, emette delle frequenze ben definite di luce (ved. il riferimento n.6 per degli esempi), percepite (se nell'intervallo del visibile) come specifici colori, e ciascuna frequenza rappresenta (tramite l'equazione mostrata sopra) la differenza di energia tra due stati dell'atomo. Tutti questi elettroni alla fine andranno nello "stato fondamentale", che è quello stabile. A causa dell'esistenza di uno stato fondamentale (determinato dalle regole quantistiche), l'elettrone non corre il rischio di scendere ancora e di "cadere" nel nucleo dell'atomo.
Una curiosità: Anche l'interno della Terra è riscaldato dall'energia nucleare, prodotta dalla radioattività di elementi come l'uranio e il potassio, per lo più sulla crosta superficiale della Terra. Per quanto gli elementi radioattivi costituiscano soltanto una piccola frazione della composizione terrestre, il calore prodotto dalla loro radiazione viene assorbito e non può facilmente sfuggire. Si consideri un'area di un metro quadrato su cui vi trovate: se tutta la crosta terrestre ha una composizione chimica simile, tutto il calore radioattivo prodotto da una colonna che si estenda per 100 Km sotto di voi può uscire soltanto attraverso questa ristretta area. (La profondità potrebbe essere maggiore, ma la produzione di calore è ridotta a grandi profondità). Si può quindi dire che gli impianti per lo sfruttamento dell'energia geotermica, le sorgenti termali e i vulcani, tutti ricavano il loro calore dal nucleo degli atomi.
E a proposito... Praticamente tutto l'elio sulla Terra (quello usato per i palloni aerostatici, per esempio) viene normalmente estratto dal gas naturale, ed ha avuto origine dalle particelle α emesse dall'uranio, dal torio o da altri elementi prodotti dal loro decadimento. Come prova, si può osservare che l'elio del Sole contiene una certa percentuale dell'isotopo 3He (1 neutrone, 2 protoni), mentre l'elio terrestre è 4He quasi puro.
Problemi:
(soluzioni nella sezione S-8A-5)
- Se il cloro è costituito per il 25% da 37Cl e per il 75% da 35Cl, e A è il numero di Avogadro, qual'è la massa di A atomi di cloro? (Questo sarebbe poi l'effettivo peso atomico del cloro naturale).
- Compilate un glossario definendo brevemente in ordine alfabetico, a parole vostre, i seguenti termini:
Atomo, Costante di Planck, Elettrone, Frequenza di un'onda EM, Fotone, Ione, Isotopo, Livello energetico, Meccanica quantistica, Molecola, Neutrino, Neutrone, Nucleo (di un atomo), Numero di Avogadro, Particella alfa, Particella beta, Peso atomico, Peso molecolare, Protone, Radiazione, Radiazione elettromagnetica, Radiazione nucleare, Raggi gamma, Stato eccitato di un atomo, Stato eccitato di un nucleo atomico, Stato fondamentale, Tempo di dimezzamento.
- Ioni con altissima energia arrivano dallo spazio ("radiazione cosmica") sulla parte superiore dell'atmosfera terrestre, collidono con gli atomi e spargono dei frammenti, alcuni dei quali sono neutroni. Un neutrone non viene deviato dalle forze magnetiche e può sfuggire in linea retta, mentre gli elettroni e i protoni vengono deflessi e possono restare intrappolati nel campo magnetico. Quelli sparpagliati dall'atmosfera vengono in genere guidati dalle forze magnetiche e rinviati di nuovo nell'atmosfera.
Questi frammenti possono essere una convincente origine della "fascia di radiazione" intrappolata nel campo magnetico terrestre?
- Un certo isotopo radioattivo ha un tempo di dimezzamento di 2 giorni. Quanto tempo occorre perché ne rimanga soltanto 1/1000 in un dato campione?
- L'idrogeno (che forma le molecole H2) pesa circa 90 grammi per metro cubo. Quante molecole di idrogeno vi sono in un micron cubo (un micron è un milionesimo di metro)?
|
